First Law Of Thermodynamics in Hindi
First Law Of Thermodynamics in Hindi
Thermodynamics को अच्छे से समझने और Thermodynamics में कोई भी Calculation करने के लिए यह बेहद ही जरूरी है कि हमे इसके Fundamentals Rules पता हों. इन्ही कुछ Fundamentals में से First Law Of Thermodynamics है।
First law of Thermodynamics in Hindi के माध्यम से इस बेहद ही उपयोगी नियम के बारे में समझने की कोशिश करेंगे.
Thermodynamics का जब विकास हो रहा था उस वक़्त Heat को Energy का एक रूप नही समझा जाता था. लेकिन कुछ वक्त के बाद यह साबित हुआ कि हीट भी ऊर्जा का ही एक रूप है, उसके बाद Heat और Work के बीच एक Relation निकलने की कोशिश होने लगी.
Heat और Work एक ही Entity के दो अलग अलग रूप है, और वह Entity, Energy कहलाती है। इसका मतलब यह हुआ कि यदि किसी System में Heat Supply की जाती है, तो वह Work के रूप में बाहर आ सकती है, या किसी सिस्टम पर Work किया जाता है, तो हीट के रूप में बाहर आ सकता है।
Heat और Work के बीच Relationship निकलने के दौरान ही एक नए शब्द से पूरी दुनियां का परिचय हुआ, जिसे Internal Energy का नाम दिया गया. Heat, Work और Internal Energy के बीच के संबंध को First Law Of Thermodynamics दिखाता है।
First Law Of Thermodynamics Statement
First law of Thermodynamics ऊर्जा संरक्षण के नियम पर आधारित है। इसमे यह कहा गया है कि "Energy को न तो बनाया जा सकता है, न ही नष्ट किया जा सकता है। इसका बस स्वरूप बदला जा सकता है।"
ये तरह से यह नियम ऊर्जा संरक्षण की ही व्याख्या करता है। ऊर्जा संरक्षण का नियम भी यही कहता है कि इस पूरे ब्रम्हांड की ऊर्जा संरक्षित है। इसे मिटाया नही जा सकता है।
Cyclic Process को आसान भाषा मे समझने के लिए एक उदाहरण ले सकते हैं। एक व्यक्ति सुबह अपने घर से आफिस के लिए निकलता है, और शाम को वापस अपने घर आ जाता है। इस तरह से यह एक Cyclic Process कहलाती है, क्योंकि वह व्यक्ति बीच मे भले ही कई काम करते हुए आया हो, लेकिन उसकी प्रारंभिक और अंतिम जगह या स्थिति तो एक ही थी।
इस तरह से यदि किसी Cyclic Process को Follow कर रहे System की बात करें तो वहां "System के द्वारा किया गया नेट वर्क, सिस्टम को Supply की गई कुल हीट के बराबर होगी।" इस स्थिति में System की Internal Energy में कोई भी परिवर्तन नही आएगा। यह नियम Close System के लिए लागू होता है।
यदि पूरी Cycle के दौरान System को कई अलग माध्यम से Heat मिल रही है, या System, Heat को Surrounding में छोंड़ रहा है। साथ ही System कई तरह के work भी कर रहा है, तो इस स्थिति में System को Supply की गई कुल हीट System के द्वारा किये गए कुल Work के बराबर होगी।
इसे इस तरह से लिखा जा सकता है।
(Integration of Work) = (integration of Heat)
Integration का मतलब होता है, सभी छोटे छोटे Amount of Heat और Work को जोड़ लेना।
यह नियम तब Applicable होता है जब System एक Cycle में Work कर रहा हो. हम यह जानते है कि Cycle की Starting और Ending Point एक ही होता है। ऐसे में इस स्थिति में सिस्टम की Internal Energy में कोई फर्क नही पड़ेगा, क्योंकि Internal Energy एक point Function है.
कोई भी Cycle 2 या 2 से अधिक पाथ से मिलकर बनती है। इस नियम को हम Cycle के अलग अलग पाथ पर भी लगा सकते हैं। इसको आसानी से समझने के लिए हम यह मान लेते हैं कि कोई एक Cycle है, जो दो Path से मिलकर बनी हुई है। इनको हम Process कह सकते हैं।
एक Process की बात करते है। इसमे यदि हम Q jule Heat की Supply करते हैं, और System इस process के दौरान W jule का Work करता है। तो यह समीकरण कुछ इस तरह का बनेगा।
Q= W + ∆U
यहाँ पर ∆U, System की Internal Energy में हुए परिवर्तन को दिखाता है. यहाँ पर यह जानना जरूरी है कि First Law Of Thermodynamics कभी भी System की Internal Energy के बारे में नही बताता है, बल्कि यह Internal Energy में हुए परिवर्तन को बस बताता है.
इस तरह से Cycle के दौरान Internal में कोई परिवर्तन नही होता है. इसलिए
और Q = W हो जाता है.
यह भी पढ़े
Thermodynamics को अच्छे से समझने और Thermodynamics में कोई भी Calculation करने के लिए यह बेहद ही जरूरी है कि हमे इसके Fundamentals Rules पता हों. इन्ही कुछ Fundamentals में से First Law Of Thermodynamics है।
First law of Thermodynamics in Hindi के माध्यम से इस बेहद ही उपयोगी नियम के बारे में समझने की कोशिश करेंगे.
Thermodynamics का जब विकास हो रहा था उस वक़्त Heat को Energy का एक रूप नही समझा जाता था. लेकिन कुछ वक्त के बाद यह साबित हुआ कि हीट भी ऊर्जा का ही एक रूप है, उसके बाद Heat और Work के बीच एक Relation निकलने की कोशिश होने लगी.
Heat और Work एक ही Entity के दो अलग अलग रूप है, और वह Entity, Energy कहलाती है। इसका मतलब यह हुआ कि यदि किसी System में Heat Supply की जाती है, तो वह Work के रूप में बाहर आ सकती है, या किसी सिस्टम पर Work किया जाता है, तो हीट के रूप में बाहर आ सकता है।
Heat और Work के बीच Relationship निकलने के दौरान ही एक नए शब्द से पूरी दुनियां का परिचय हुआ, जिसे Internal Energy का नाम दिया गया. Heat, Work और Internal Energy के बीच के संबंध को First Law Of Thermodynamics दिखाता है।
First Law Of Thermodynamics Statement
First law of Thermodynamics ऊर्जा संरक्षण के नियम पर आधारित है। इसमे यह कहा गया है कि "Energy को न तो बनाया जा सकता है, न ही नष्ट किया जा सकता है। इसका बस स्वरूप बदला जा सकता है।"
ये तरह से यह नियम ऊर्जा संरक्षण की ही व्याख्या करता है। ऊर्जा संरक्षण का नियम भी यही कहता है कि इस पूरे ब्रम्हांड की ऊर्जा संरक्षित है। इसे मिटाया नही जा सकता है।
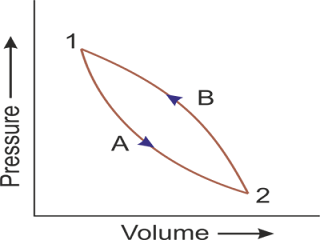
First Law of Thermodynamics For a Cycle
जब भी कोई System एक Cycle को Follow करता है, तब उसका System का प्रारंभ और अंत एक ही बिंदु पर होगा। इसका कारण यह है कि Cyclic Process पर चलने वाला System एक खास तरह की Process को बार बार करता है।Cyclic Process को आसान भाषा मे समझने के लिए एक उदाहरण ले सकते हैं। एक व्यक्ति सुबह अपने घर से आफिस के लिए निकलता है, और शाम को वापस अपने घर आ जाता है। इस तरह से यह एक Cyclic Process कहलाती है, क्योंकि वह व्यक्ति बीच मे भले ही कई काम करते हुए आया हो, लेकिन उसकी प्रारंभिक और अंतिम जगह या स्थिति तो एक ही थी।
इस तरह से यदि किसी Cyclic Process को Follow कर रहे System की बात करें तो वहां "System के द्वारा किया गया नेट वर्क, सिस्टम को Supply की गई कुल हीट के बराबर होगी।" इस स्थिति में System की Internal Energy में कोई भी परिवर्तन नही आएगा। यह नियम Close System के लिए लागू होता है।
यदि पूरी Cycle के दौरान System को कई अलग माध्यम से Heat मिल रही है, या System, Heat को Surrounding में छोंड़ रहा है। साथ ही System कई तरह के work भी कर रहा है, तो इस स्थिति में System को Supply की गई कुल हीट System के द्वारा किये गए कुल Work के बराबर होगी।
इसे इस तरह से लिखा जा सकता है।
(Integration of Work) = (integration of Heat)
Integration का मतलब होता है, सभी छोटे छोटे Amount of Heat और Work को जोड़ लेना।
यह नियम तब Applicable होता है जब System एक Cycle में Work कर रहा हो. हम यह जानते है कि Cycle की Starting और Ending Point एक ही होता है। ऐसे में इस स्थिति में सिस्टम की Internal Energy में कोई फर्क नही पड़ेगा, क्योंकि Internal Energy एक point Function है.
First Law of Thermodynamics For a Process
कोई भी Cycle 2 या 2 से अधिक पाथ से मिलकर बनती है। इस नियम को हम Cycle के अलग अलग पाथ पर भी लगा सकते हैं। इसको आसानी से समझने के लिए हम यह मान लेते हैं कि कोई एक Cycle है, जो दो Path से मिलकर बनी हुई है। इनको हम Process कह सकते हैं।
एक Process की बात करते है। इसमे यदि हम Q jule Heat की Supply करते हैं, और System इस process के दौरान W jule का Work करता है। तो यह समीकरण कुछ इस तरह का बनेगा।
 |
| First Law Of Thermodynamics |
Q= W + ∆U
यहाँ पर ∆U, System की Internal Energy में हुए परिवर्तन को दिखाता है. यहाँ पर यह जानना जरूरी है कि First Law Of Thermodynamics कभी भी System की Internal Energy के बारे में नही बताता है, बल्कि यह Internal Energy में हुए परिवर्तन को बस बताता है.
इस तरह से Cycle के दौरान Internal में कोई परिवर्तन नही होता है. इसलिए
∆U= 0
और Q = W हो जाता है.
यह भी पढ़े
Zeroth Law Of Thermodynamic shttps://techmechlstudy.blogspot.com/2019/04/zeroth-law-of-thermodynamics.html?m=
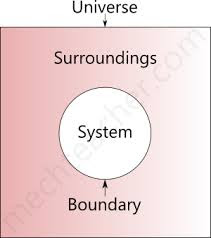
What is Thermodynamics System




टिप्पणियाँ
एक टिप्पणी भेजें